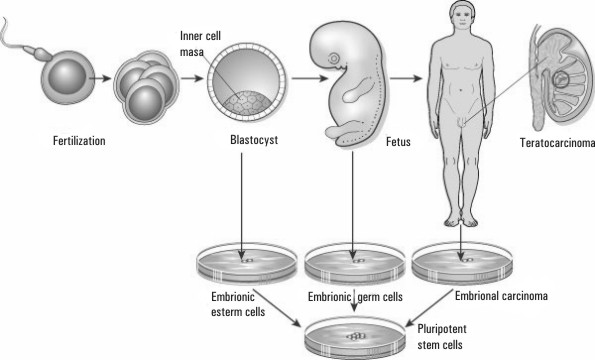
Célula madre es una célula totipotente/pluripotente o multipotente, capaz de generar uno o más tipos de células diferenciadas y que además posee la capacidad de autorrenovación. En los animales superiores, cuando nos referimos a células madre, pensamos en las células totipotentes embriónicas, que a su vez se clasifican en los siguientes grupos: células madre embriónicas (ES), células madre germinales (EG) y células madre de los teratomas y teratocarcinomas. Sin embargo, la mayoría de los tejidos adultos que forman parte del organismo de estos animales superiores, poseen la capacidad intrínseca de auto renovarse, a partir de poblaciones celulares que permanecen remanentes en quiescencia durante la vida del animal, pero que mantienen la capacidad de diferenciación. Este proceso ha abierto una nueva era en la llamada medicina regenerativa, que no es más que aprovechar los mecanismos naturales de renovación celular para reparar los tejidos dañados. Sin embargo, este nuevo concepto en la medicina no solo ha planteado nuevas posibles vías terapéuticas de estudio, tales como las llamadas terapias celulares, sino que también ha abierto sin duda la "caja de pandora", que exige no solo un debate científico sino ético por parte de la sociedad en general.
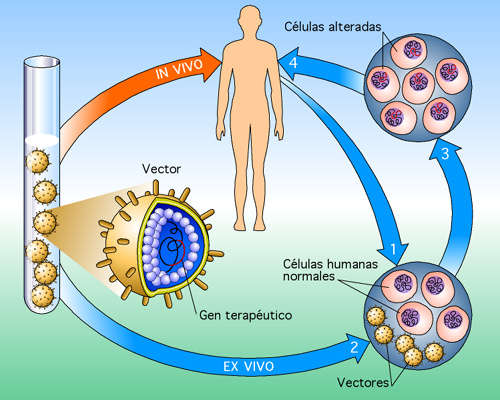
La diabetes tipo 1 es caracterizada por deficiencia de células beta que tiene un fallo en la homeostasis de la glucosa lo que ocasiona una variedad de complicaciones severas que ha llevado a la generación de células secretoras de insulina procedentes de células madres embrionarias y adultas pero no tienen la funcionalidad completa de las células beta. Al considerar que ni la predicción ni la prevención sirve para evitar la aparición de la DM1, la sustitución de las células ß por islotes procedentes de cadáveres es la única terapia disponible que permite el control de la glucosa sanguínea sin recurrir a la terapia exógena con insulina. El alotrasplante de islotes pancreáticos se ha demostrado que es capaz de normalizar los niveles de glucosa sanguínea y de bloquear el progreso de las complicaciones que van asociadas a esta enfermedad. Por tanto es el trasplante de islotes pancreáticos procedentes de donantes lo que ha establecido la terapia celular en la diabetes mellitus.
Referencia:
http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532004000200007
http://www.analesranf.com/index.php/mono/article/viewFile/949/937